"Нанометр" параллельно с сайтом химического факультета МГУ продолжает публикацию материалов лекций общего потока 1 курса химического факультета МГУ им. М.В.Ломоносова "Общая и неорганическая химия", которые (надеемся, что лишь с небольшой задержкой) будут появляться 2 раза в неделю и содержать как иллюстративные материалы, так и "живую" видеозапись лекции. В каждой лекции будут содержаться один или несколько вопросов для размышлений, направленных на подготовленных (точнее, мотивированных студентов).
Ниже приводятся материалы лекции с двадцать шестой по двадцать седьмую для химиков (Большая химическая аудитория, химический факультет МГУ), сначала иллюстративные, потом появится видеозапись.
Название лекции: Лекция 26-27. Элементы 13 группы.
Лектор: проф. А.В.Шевельков
Демонстрационные эксперименты: к.х.н., доц. С.Г.Дорофеев
Аудитория: БХА, химфак МГУ
Уровень: "новобранцы" химического факультета МГУ (студенты - химики)
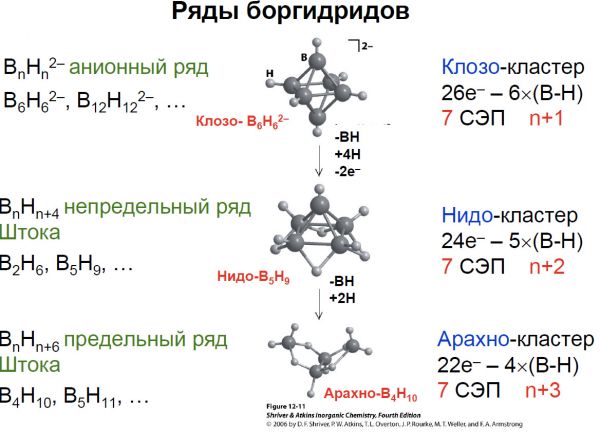
Дополнительные вопросы лектора для официальных слушателей (повышение рейтинга по курсу для желающих): что такое нейтрон-захватная терапия онкологических заболеваний и какое отношение к ней имеет бор? Объясните причины существования низкой температуры плавления у металлического индия (ответы присылать на адрес электронной почты, указанный на 1 слайде ПЕРВОЙ лекции) Текущие ответы собираются, в декабре будет сделана проверка всех присланных решений.
Архивы лекций прошлых лет и предщественники - аналоги текущих лекций можно посмотреть на сайте химического факультета МГУ, в разделе учебных материалов по неорганической химии. Просьба обратить внимание, что перепечатка материалов с сайта химического факультета запрещена политикой конфиденциальности сайта химического факультета МГУ.
Использование приводящихся ниже материалов лекций в коммерческих целях также запрещено, запрещается также размещение лекций на других сайтах без согласования с авторами лекций (разумеется, за исключением сайта химического факультета МГУ, где они также будут постепенно появляться). При использовании (полном или частичном) материалов лекций в образовательных целях ссылка на текущий адрес лекции (гиперссылка) с указанием авторства и принадлежности лекций химическому факультету МГУ безусловно ОБЯЗАТЕЛЬНЫ.
Предыдущие лекции:
- Лекция 1. Первый закон термодинамики. ДОБАВЛЕНО ВИДЕО.
- Лекция 2. Второй закон термодинамики. ДОБАВЛЕНО ВИДЕО.
- Лекция 3. Свободная энергия. ДОБАВЛЕНО ВИДЕО.
- Лекция 4. Константы равновесия. ДОБАВЛЕНО ВИДЕО.
- Лекция 5. Фазовые равновесия. ДОБАВЛЕНО ВИДЕО.
- Лекция 6. Растворы (часть1). ДОБАВЛЕНО ВИДЕО.
- Лекция 7. Растворы (часть 2). ДОБАВЛЕНО ВИДЕО.
- Лекция 8. Кинетика химических реакций. ДОБАВЛЕНО ВИДЕО.
- Лекция 9. Электронное строение атома. ДОБАВЛЕНО ВИДЕО.
- Лекция 10. Периодический закон. ДОБАВЛЕНО ВИДЕО.
- Лекция 11. Модели химической связи. ДОБАВЛЕНО ВИДЕО.
- Лекция 12. Геометрия молекул. ДОБАВЛЕНО ВИДЕО.
- Лекция 13. Водород. ДОБАВЛЕНО ВИДЕО.
- Лекция 14. Галогены - 1. ДОБАВЛЕНО ВИДЕО.
- Лекция 15. Галогены - 2. ДОБАВЛЕНО ВИДЕО.
- Лекция 16. Галогены - 3. ДОБАВЛЕНО ВИДЕО.
- Лекция 17. Халькогены (часть 1). ДОБАВЛЕНО ВИДЕО.
- Лекция 18. Халькогены (часть 2). ДОБАВЛЕНО ВИДЕО.
- Лекция 19-21. Пниктогены. ДОБАВЛЕНО ВИДЕО.
- Лекции 22. Зонная теория. ДОБАВЛЕНО ВИДЕО.
- Лекции 23-25. Элементы 14 группы. ДОБАВЛЕНО ВИДЕО.
Lecture_group13-2011.pdf (1.25 Мб.) Материалы лекций (при использовании ссылка на авторство, гиперссылка на постоянный адрес лекции и принадлежность материалов курсу "Общая и неорганическая химия" химического факультета МГУ обязательны!). | |