"Нанометр" параллельно с сайтом химического факультета МГУ продолжает публикацию материалов лекций общего потока 1 курса химического факультета МГУ им. М.В.Ломоносова "Общая и неорганическая химия", которые (надеемся, что лишь с небольшой задержкой) будут появляться 2 раза в неделю и содержать как иллюстративные материалы, так и "живую" видеозапись лекции. В каждой лекции будут содержаться один или несколько вопросов для размышлений, направленных на подготовленных (точнее, мотивированных студентов).
Ниже приводятся материалы четырнадцатой лекции для химиков (Большая химическая аудитория, химический факультет МГУ), сначала иллюстративные, потом появится видеозапись.
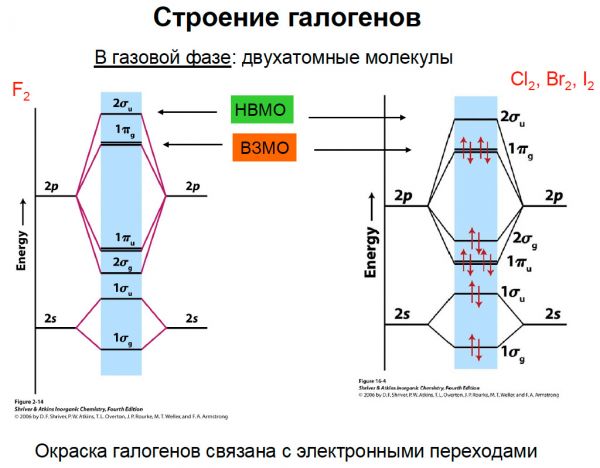
Название лекции: Лекция 14. Галогены (часть 1).
Лектор: проф. А.В.Шевельков
Демонстрационные эксперименты: к.х.н., доц. С.Г.Дорофеев
Аудитория: БХА, химфак МГУ
Уровень: "новобранцы" химического факультета МГУ (студенты - химики)
Дополнительные вопросы лектора для официальных слушателей (повышение рейтинга по курсу для желающих): какие "оксиды фтора" Вы знаете и каково их электронное строение? (ответы присылать на адрес электронной почты, указанный на 1 слайде ПЕРВОЙ лекции) Текущие ответы собираются, в октябре будет сделана проверка всех присланных решений.
Архивы лекций прошлых лет и предщественники - аналоги текущих лекций можно посмотреть на сайте химического факультета МГУ, в разделе учебных материалов по неорганической химии. Просьба обратить внимание, что перепечатка материалов с сайта химического факультета запрещена политикой конфиденциальности сайта химического факультета МГУ.
Использование приводящихся ниже материалов лекций в коммерческих целях также запрещено, запрещается также размещение лекций на других сайтах без согласования с авторами лекций (разумеется, за исключением сайта химического факультета МГУ, где они также будут постепенно появляться). При использовании (полном или частичном) материалов лекций в образовательных целях ссылка на текущий адрес лекции (гиперссылка) с указанием авторства и принадлежности лекций химическому факультету МГУ безусловно ОБЯЗАТЕЛЬНЫ.
Предыдущие лекции:
- Лекция 1. Первый закон термодинамики. ДОБАВЛЕНО ВИДЕО.
- Лекция 2. Второй закон термодинамики. ДОБАВЛЕНО ВИДЕО.
- Лекция 3. Свободная энергия. ДОБАВЛЕНО ВИДЕО.
- Лекция 4. Константы равновесия. ДОБАВЛЕНО ВИДЕО.
- Лекция 5. Фазовые равновесия. ДОБАВЛЕНО ВИДЕО.
- Лекция 6. Растворы (часть1). ДОБАВЛЕНО ВИДЕО.
- Лекция 7. Растворы (часть 2). ДОБАВЛЕНО ВИДЕО.
- Лекция 8. Кинетика химических реакций. ДОБАВЛЕНО ВИДЕО.
- Лекция 9. Электронное строение атома. ДОБАВЛЕНО ВИДЕО.
- Лекция 10. Периодический закон. ДОБАВЛЕНО ВИДЕО.
- Лекция 11. Модели химической связи. ДОБАВЛЕНО ВИДЕО.
- Лекция 12. Геометрия молекул. ДОБАВЛЕНО ВИДЕО.
- Лекция 13. Водород. ДОБАВЛЕНО ВИДЕО.
lecture14-16.pdf (1.04 Мб.) Материалы лекций (при использовании ссылка на авторство, гиперссылка на постоянный адрес лекции и принадлежность материалов курсу "Общая и неорганическая химия" химического факультета МГУ обязательны!). | |