Долгое времени считалось, что реакция циклоприсоединения является исключительно синтетическим методом органической химии и не встречается в природе, поскольку не было достоверных доказательств существования ферментов, катализирующих такой процесс. Интереснейшей находкой оказалась бактерия Saccharopolyspora spinosa - этот микроорганизм, как выяснилось, способен осуществить внутримолекулярную реакцию [4+2] циклоприсоединения. Теоретическое исследование механизма реакции циклоприсоединения, выполненное в Институте органической химии им. Н.Д. Зелинского Российской Академии Наук (Москва), выявило энергетически сбалансированную координату реакции для этого уникального процесса. Результаты исследования, опубликованного в журнале PLOS ONE (doi: 10.1371/journal.pone.0119984), дают новое представление о механизме ферментативной реакции циклоприсоединения.
Механизм ферментативной реакции циклоприсоединения пока остается загадкой.
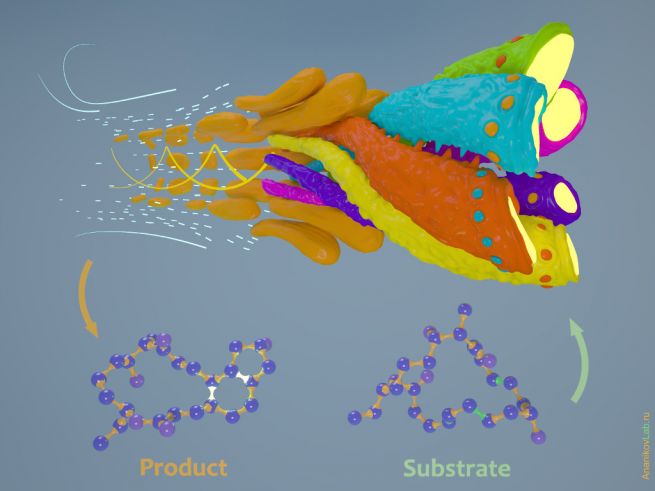
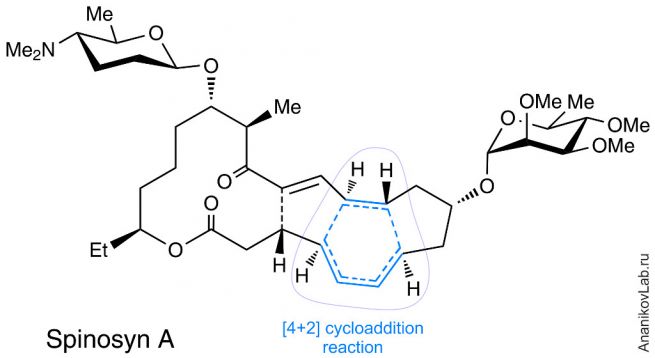
До недавнего времени предполагалось, что реакции циклоприсоединения (также широко известные как реакции Дильса-Альдера) не встречаются в живой природе, и ферменты, катализирующие такие процессы, также не были известны. Однако спустя некоторое время были открыты некоторые микроорганизмы, поставившие себе на службу реакцию внутримолекулярного [4+2] циклоприсоединения. Оказалось, что кое-кто в живой природе все-таки умеет осуществлять такие превращения: совсем недавно в клетках бактерии Saccharopolyspora spinosa был обнаружен фермент SpnF, катализирующий внутримолекулярную реакцию Дильса-Альдера, в результате которой образуется Спинозин А – природный тетрациклический инсектицид. Действительно, внутримолекулярная реакция [4+2] циклоприсоединения является наиболее оптимальным способом для получения полициклической основы Спинозина А (рис.1).
Рис. 1. Синтез молекулы Спинозина А происходит в результате реакции Дильса-Альдера.
В лабораторных условиях такие химические превращения требуют относительно жестких условий. Например, высоких температур в районе 80-120 °C, которые недостижимы внутри живых клеток. Уникальной особенностью ферментов является их способность обеспечивать протекание реакции с высокой селективностью при намного меньших температурах. В таких процессах обязательно необходим катализатор для уменьшения энергии активации реакции. Следствием катализа является намного более высокая скорость реакции по сравнению с некаталитическим процессом. Несмотря на то, что катализатор активно участвует в химическом превращении, он полностью регенерируется по его завершении и способен снова катализировать химические реакции.
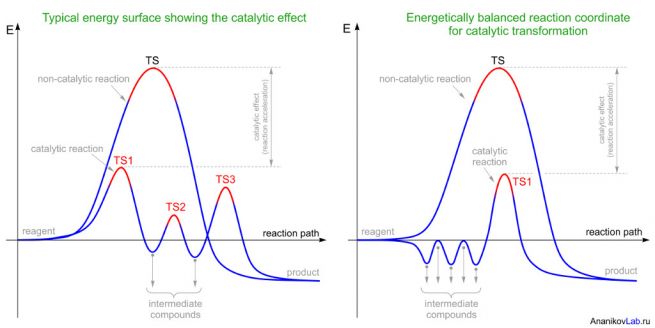
В общепринятой модели ферментативного катализа одностадийная некаталитическая реакция с высокой энергией активации заменяется многостадийной каталитической реакцией, протекающей через последовательность переходных состояний и промежуточных продуктов с низкой энергией (рис. 2, слева). В рамках этой общепринятой схемы оказывается невозможным объяснение значительного каталитического эффекта в реакции циклоприсоединения, приводящей к молекуле Спинозина А. В результате моделирования методами квантовой химии было показано, что классическая схема обеспечивает незначительное уменьшение энергии активации, то есть не приводит к существенному ускорению реакции.
Новый механизм ферментативной реакции образования Спинозина А был предложен и количественно охарактеризован теоретическими методами в работе профессора В.П. Ананикова и сотрудников из Института органической химии им. Н.Д. Зелинского РАН. Предлагаемый авторами механизм обеспечивает значительно больший каталитический эффект ферментативной реакции для данной реакции по сравнению с общепринятой схемой.
Рис. 2. Общепринятый путь каталитической реакции (слева) и предлагаемый в работе энергетически сбалансированный путь каталитической реакции (справа); ПС обозначает переходное состояние.
В рамках предложенной модели допускается, что гибкая молекула циклического субстрата может сжиматься под действием окружения в активном центре фермента, в результате чего происходит сближение соединящихся фрагментов молекулы (диен и диенофил, рис. 1) в составе молекулы субстрата до достижения состояния, очень близкого к переходному состоянию реакции циклоприсоединения.
Однако сжатие молекулы приводит к увеличению ее энергии. Это увеличение энергии компенсируется за счет образования водородных связей между молекулой субстрата и аминокислотными остатками в активном центре фермента. После нескольких стадий такого сжатия/компенсации полная энергия системы изменяется незначительно, однако структура молекулы субстрата значительно приближается к структуре переходного состояния. После этого даже небольшое смещения атомов углерода, участвующих в реакции циклоприсоединения, приводят к достижению точки переходного состояния и далее к образованию продукта реакции. Таким образом, общий путь реакции включает несколько промежуточных состояний и только одно переходное состояние (рис. 2, справа).
Если рассмотреть механизм реакции более детально, то можно отметить следующее:
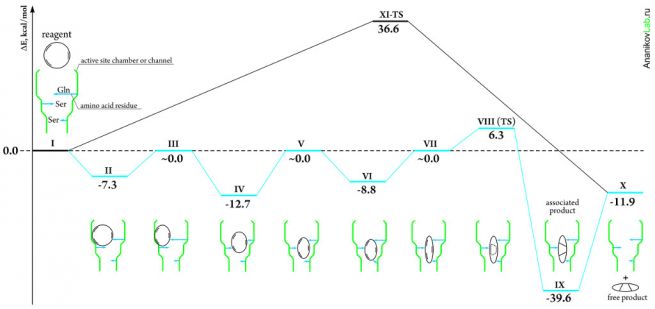
Общепринятый механизм. Методами молекулярного моделирования в работе показано, что координация аминокислот, имитирующих окружение в активном центре фермента, таких как глутамин и серин (всего до трех молекул аминокислот) с молекулой субстрата приводит к незначительному уменьшению энергии активации: от 27.8 ккал/моль для изолированной молекулы субстрата до 25.1 ккал/моль для ассоциированной с тремя молекулами аминокислот молекулы субстрата (на уровне теории - B3LYP/6-311+G(d)). Такое снижение барьера реакции, конечно, вносит свой вклад в ускорение процесса, но не может иметь принципиального значения.
Энергетически сбалансированная координата реакции. Для объяснения большего каталитического эффекта авторами работы предложена другая модель ферментативного катализа. Реакция начинается в точке I, соответствующей изолированным молекулам субстрата и фермента. В результате специфического взаимодействия между ними, субстрат располагается в активном сайте фермента (точка II), причем в процессе перехода системы из состояния (I) в состояние (II) происходит уменьшение энергии системы на 7.3 ккал/моль за счет образования водородных связей между молекулами фермента и субстрата. Затем происходит сжатие молекулы субстрата (III), таким образом, что выигрыш энергии, полученный в результате координации первого аминокислотного остатка, компенсируется, и полная энергия системы повышается до уровня энергии системы (I). Далее происходит координация второго аминокислотного остатка (IV), снова сопровождающаяся уменьшением энергии, и последующее сжатие субстрата (V), компенсирующее это уменьшение. В результате третьей стадии координации-сжатия (VI-VII) субстрат геометрически приближается к переходному состоянию (VIII), которое в свою очередь стабилизировано координацией с тремя аминокислотами так, что его образование уже не требует того количества энергии, как если бы оно формировалось из точки (II). После того как стадия циклоприсоединения завершилась, продукт остается какое-то время в ассоциированном с ферментом состоянии (IX), и лишь затем покидает полость активного сайта (X). В результате энергия активации такого процесса (если отсчитывать ее от самой энергетически низкой точки IV) составляет 19.0 ккал/моль, что по сравнению с 36.6 ккал/моль для некаталитического процесса (черная линия на рисунке) представляет собой значительное уменьшение энергии активации.
Рис. 3. Энергетически сбалансированная координата реакции (синяя кривая) характеризуется намного меньшей энергией активации по сравнению с некаталитическим процессом (черная кривая).
Таким образом, в предложенном механизме каталитический эффект достигается за счет движения по энергетически сбалансированной координате реакции. Сжатие молекулы субстрата в активном центре фермента и приближение к структуре продукта достигаются за счет ступенчатого процесса, сопровождающегося образованием водородных связей. Принципиально важно отметить, что данное превращение проходит всего лишь через одно переходное состояние. В отличие от общеизвестных представлениях об энзиматическом катализе, где постулируется обязательное наличие нескольких переходных состояний. Полученный результат развивают наши представления о механизмах работы энзимов и открывают новые возможности для создания каталитических превращений.
Статья «Computational Study of a Model System of Enzyme-Mediated [4+2] Cycloaddition Reaction» (авторы Evgeniy G. Gordeev, Valentine P. Ananikov) опубликована в журнале PLOS ONE.
Ссылка: PLOS ONE, 2015; DOI: 10.1371/journal.pone.0119984
Веб-сайт: http://dx.doi.org/10.1371/journal.pone.0119984