Группе ученых из США впервые удалось получить аэрогели с каркасной структурой на основе сульфидов и селенидов металлов. Полученные материалы уже сейчас могут быть использованы для тонкой очистки воды, а в будущем смогут очищать водород для топливных ячеек.
На сегодняшний день большинство неорганических пористых материалов, разработанных для производства молекулярных сит, ионообменных фильтров и катализаторов, получают на основе оксидов металлов. Наиболее распространенными классами соединений, которые используются в промышленности для этих целей, являются цеолиты и алюмосиликаты. Аэрогели – принципиально другой класс пористых неорганических аморфных полимеров, в которых структурные блоки с размерами порядка нескольких десятков нанометров соединены в структуры с высокоразвитой поверхностью, очень малой плотностью и очень большими порами.
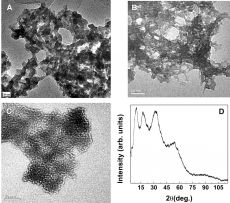
Суть разработанного в Арагонской Национальной лаборатории (государственный департамент США) метода получения высокопористых полупроводящих гелей заключается в соединении халькогенидных кластеров в каркасы через ионы металлов. Сначала готовят водные растворы, в которых присутствуют анионные комплексы халькогенидов, например [MQ4]4–, [M2Q6]4– и [M4Q10]4– (M = Ge, Sn; Q = S, Se) (рис. 1А). Затем при добавлении солей платины происходит образование протяженных полимерных каркасов, в которых все атомы связаны ковалентной связью. В ходе получения образующийся материал адсорбирует молекулы растворителя, и, таким образом, образуется гидрогель. После сушки полученного вещества в жестких условиях в атмосфере углекислого газ образуется аэрогель. Этот класс материалов и получил название "халькогели". Результаты просвечивающей электронной микроскопии показали наличие в халькогелях неупорядоченных пор.
Халькогели способны очень эффективно очищать воду, загрязненную тяжелыми металлами. Так, после очистки воды с содержанием ртути 645 ppm (ppm – «одна миллионная») десятью миллиграммами этого вещества в воде остается всего 0,04 ppm ионов ртути. Распространенные сейчас силикагели могут лишь приблизиться к подобному результату только после специальной модификации их поверхности серосодержащими лигандами.
Поскольку элементы, из которых состоят халькогели, находятся в одной группе с кислородом в периодической системе Д.И. Менделеева, исследователи надеются, что они смогут эффективно адсорбировать примеси в потоке водорода. Варьируя условия получения гелей, можно легко контролировать размеры и форму пор и, таким образом, селективно подбирать материал под определенные частицы примеси.
Гели имеют одно важное преимущество по сравнению с порошками. Поскольку большинство материалов легко «сцепляются» с гелями, это позволяет сохранять им аномально высокую площадь поверхности: один кубический сантиметр аэрогеля по площади поверхности равен футбольному полю. А чем больше поверхность, тем более эффективна очистка.
Кроме того, в отличие от оксидных материалов, халькогели обладают полупроводниковыми свойствами. Это открывает большие перспективы как для дальнейшего изучения этого класса уникальных материалов, так и для усовершенствования технологий их применения на практике. Первые исследования показали, что размеры пор в халькогелях могут меняться при воздействии излучения. Таким образом, чувствительностью и проницаемостью мембран на основе этого класса соединений можно будет легко управлять в режиме реального времени.
Перевод - С.Гутников (ФНМ МГУ)


 И поверьте, не менее эффективно. Наверно в ФНМ студентам рассказывали о произведении растворимости. Там ищщо задачки с иксами такими, всякими. Но в Science вас не напечатают предложи вы такую ерунду. Есть ищщо хелатные ионообменные волокна (В Москве в ближайшем хозмаге за углом) с приличной емкостью и селективностью по отношению к тяжелым металлам а не только р-р-ртути. А вот сорбент на основе платины, это по богатому. Если найдете где такие фильтры по доллару, свистните мне, я из них платину добывать буду. Таперича давайте включим голову и подумаем. Заявленная емкость 6 ммоль на грамм, к слову, типичная для ионообменников. Но куды, скажите, куды ртуть там сорбируется? Ион ртути как никак имеет заряд +2. В "пору" он просто так не полезет ни за какие коврижки. Ему нужна подруга жизни с зарядом -2: сера. О банальном ионнном обмене речь не идет: нечему там обмениваться. Ответ похоже один - идет реакция с разрушением оного комплекса и образованием сульфида ртути. Интересно что же попадет в раствор. Но энто авторам статьи неинтересно.
И поверьте, не менее эффективно. Наверно в ФНМ студентам рассказывали о произведении растворимости. Там ищщо задачки с иксами такими, всякими. Но в Science вас не напечатают предложи вы такую ерунду. Есть ищщо хелатные ионообменные волокна (В Москве в ближайшем хозмаге за углом) с приличной емкостью и селективностью по отношению к тяжелым металлам а не только р-р-ртути. А вот сорбент на основе платины, это по богатому. Если найдете где такие фильтры по доллару, свистните мне, я из них платину добывать буду. Таперича давайте включим голову и подумаем. Заявленная емкость 6 ммоль на грамм, к слову, типичная для ионообменников. Но куды, скажите, куды ртуть там сорбируется? Ион ртути как никак имеет заряд +2. В "пору" он просто так не полезет ни за какие коврижки. Ему нужна подруга жизни с зарядом -2: сера. О банальном ионнном обмене речь не идет: нечему там обмениваться. Ответ похоже один - идет реакция с разрушением оного комплекса и образованием сульфида ртути. Интересно что же попадет в раствор. Но энто авторам статьи неинтересно.