Свойства организма определяются не только генами и средой, но и случайным шумом, который неизбежно присутствует на всех уровнях биологической организации начиная с молекулярного. Наблюдение за жизнью бактериальных клеток в реальном времени позволило голландским биологам напрямую оценить вклад этого малоизученного фактора в изменчивость бактерий по таким важным параметрам, как скорость роста, уровень экспрессии генов и концентрация ферментов. Как выяснилось, все эти показатели подвержены сильным хаотическим колебаниям, причем флуктуации разных подсистем клетки сложным образом влияют друг на друга.
Изменчивость — фундаментальное свойство живых организмов, определения которого можно найти в любом учебнике или биологическом словаре. В этих определениях изменчивость обычно рассматривается как результат либо генетических различий между индивидами (такую изменчивость называют наследственной или генотипической), либо различающихся условий среды (ненаследственная, или модификационная изменчивость). При этом часто оговаривается (совершенно справедливо), что грань между двумя формами изменчивости — нечеткая и даже во многом искусственная, поскольку фенотип определяется сложным переплетением взаимодействующих генетических и средовых факторов. Например, то, как и в каких пределах будет меняться фенотип при колебаниях внешних условий, во многом определяется генами (см. Норма реакции), а то, каким образом данное генетическое изменение отразится на фенотипе, во многом зависит от среды.
Биологи проводят множество исследований, чтобы оценить относительный вклад генетических и средовых факторов в наблюдаемую изменчивость. Однако при этом часто упускают из виду, что кроме генов и среды существует еще и третий источник вариабельности — случайный шум, который обязательно (исходя из самых общих соображений) должен присутствовать в том или ином виде на всех уровнях биологической организации начиная с молекулярного.
Молекулярные процессы в клетке по своей природе стохастичны, о чем «Элементы» уже не раз рассказывали. Например, в новости Работу регуляторного белка впервые пронаблюдали под микроскопом («Элементы», 31.05.2007) говорится о том, как регуляторный белок ищет свой сайт связывания на хромосоме, раз за разом прикрепляясь к ней в случайных местах и совершая короткие «пробежки» (см. также: Разгадан механизм движения «шагающего белка», «Элементы», 29.05.2007).
Элемент стохастики в работе регуляторных генных сетей наиболее очевиден, потому что многие регуляторные белки — это «штучный товар», они присутствуют в клетке в небольшом количестве. Между тем отрегулировать экспрессию гена с абсолютной точностью едва ли возможно. Как добиться, чтобы в клетке постоянно находилось ровно 18 молекул данного белка? Наверняка будет получаться то 16, то 19. Эта вариабельность, в свою очередь, будет влиять на свойства клетки.
В онтогенезе многоклеточных случайный шум, возникающий на уровне молекул и клеток, по идее, должен был бы накапливаться, приводя к нестабильному фенотипу. Очевидно, в этом причина неполной пенетрантности многих мутаций, которые у одних особей проявляются в фенотипе, а у других нет, даже если они генетически идентичны и развивались в сходных условиях (см.: Избыточность регуляторных сетей делает развитие помехоустойчивым, «Элементы», 22.02.2010). Если же на самом деле генетически идентичные организмы, выращенные в одинаковых условиях, обычно оказываются очень похожими друг на друга, то это — нетривиальный факт, требующий объяснений (как бы непривычно ни звучало подобное утверждение). Самое общее объяснение, по-видимому, состоит в том, что у организмов в ходе эволюции неизбежно развиваются эффективные адаптации для повышения помехоустойчивости, такие как, например, регуляторные контуры, основанные на отрицательных обратных связях, и белки-шапероны (см.: Стресс помогает справиться с вредными мутациями, «Элементы», 17.01.2012).
Если стохастичность регуляторных генных сетей в последние годы изучается довольно активно, то о роли случайности в других базовых биологических процессах, таких как метаболизм (обмен веществ), известно гораздо меньше.
Исследователи из Нидерландского института атомной и молекулярной физики (AMOLF) отчасти восполнили этот пробел, проследив за жизнью индивидуальных бактерий E. coli в реальном времени. Ученых интересовала вариабельность таких параметров, как скорость роста клеток и уровень экспрессии (активности) генов ферментов, участвующих в метаболизме. Кроме того, в задачи исследования входил поиск причинно-следственных связей между колебаниями разных параметров клетки.
В ходе эксперимента бактерий кормили синтетическим, не встречающимся в природе сахаром лактулозой. Кишечные палочки утилизируют лактулозу при помощи ферментов LacY и LacZ, которые в обычных условиях используются для переваривания лактозы. Гены этих ферментов входят в состав хорошо изученного лактозного оперона. Лактулоза, в отличие от лактозы, не влияет на экспрессию лактозного оперона. Это дало возможность исследователям регулировать активность оперона (добавляя в среду то или иное количество индуктора — ИПТГ) независимо от количества пищи, получаемой бактериями. Это было необходимо, чтобы сравнить поведение бактерий в условиях, когда количество пищеварительных ферментов является лимитирующим фактором (ограничивающим рост) и когда этих ферментов производится с избытком (см. ниже). В лактозный оперон был добавлен ген зеленого флюоресцирующего белка, чтобы по силе флюоресценции можно было оценивать активность оперона и концентрацию ферментов в клетке.
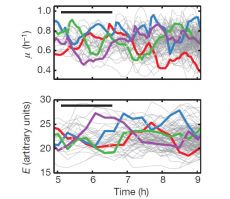
Каждую бактерию, а затем ее потомков вплоть до 8–9-го поколения, фотографировали с интервалом в несколько минут (рис. 1; см.: Time-lapse microscopy). Компьютерный анализ полученных изображений позволил оценить колебания скорости роста клеток (μ) и концентрации ферментов в них (E) (рис. 2).
Эти колебания оказались, во-первых, вполне хаотическими, во-вторых — неожиданно большими по амплитуде. Например, скорость роста в одной и той же линии клеток может измениться вдвое всего за час-полтора, то есть за время, сопоставимое с интервалом между делениями (под «линией» понимается последовательность, включающая данную клетку, одного ее случайно выбранного потомка после деления, одного случайно выбранного «внука» и т. д.) При этом, как видно на рис. 2, колебания μ и Eне зависят от фазы клеточного цикла: моменты клеточных делений не приурочены ни к минимумам, ни к максимумам, ни к каким-либо иным «особым» точкам на графиках колебаний μ и E. Дочерняя клетка «наследует» от родительской клетки ее текущее состояние, но память у такой «наследственности» короткая: уже через несколько часов корреляция между исходным и нынешним состоянием клетки полностью исчезает (равно как и корреляция между состоянием сестринских клеток — потомков одной родительской бактерии).
Дальнейшие изыскания авторов сосредоточились вокруг вопроса о взаимном влиянии изучаемых параметров и их флуктуаций. Влияет ли шум на уровне концентрации ферментов на колебания скорости роста или, может быть, шум передается в обратном направлении? Оба варианта теоретически возможны. Понятно, что скорость роста может зависеть от концентрации катаболических ферментов, поскольку чем выше эта концентрация, тем быстрее усваивается пища. Возможно и обратное влияние за счет эффекта «разбавления» ферментов при быстром росте клетки.
Чтобы разобраться в направленности передачи шума (noise transmission), авторы оценивали корреляции между колебаниями μ и E в разные моменты времени. Идея в том, что если преобладает причинно-следственная связь, направленная от E к μ(концентрация ферментов влияет на скорость роста), то величина E в момент времени t будет лучше коррелировать с величиной μ в последующие моменты времени, чем в предшествующие. И наоборот, если преобладает влияние μ на E, то сильнее будет корреляция между величиной E в данный момент и предшествующими значениями μ.
Авторам удалось показать, что «передача шума» действительно имеет место, причем ее направленность зависит от условий. Если ферментов производится мало (при низкой концентрации индуктора ИПТГ), то концентрация ферментов оказывается лимитирующим фактором: она ограничивает рост. Как и следовало ожидать, в такой ситуации колебания E заметно сказываются на флуктуациях μ. Случайный шум частично передается от E к μ, так что в итоге до 30% наблюдаемой вариабельности клеток по скорости роста определяется вариабельностью по E.
Если же ферментов производится с избытком, то колебания их концентрации уже не влияют на скорость роста. В этом случае передача шума идет в основном в обратную сторону: от μ к E, за счет эффекта разбавления. Такой же эффект получается и в том случае, если кормить бактерий не лактулозой, а чем-нибудь другим: например, ацетатом, для утилизации которого не нужны ферменты катаболизма лактозы. В этом случае E не влияет на μ, и шум передается только от μ к E, но не в обратную сторону.
В ходе дополнительных экспериментов авторы показали, что флуктуации скорости роста сказываются (за счет разбавления) не только на концентрации ферментов катаболизма лактозы, но и на концентрации других белков в клетке.
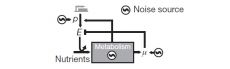
Сложная статистическая обработка данных вместе с математическим моделированием в итоге привели авторов к схеме, показанной на рис. 3. Случайный шум генерируется в трех узлах системы, соответствующих уровню экспрессии генов катаболических ферментов (p), скорости роста клетки (μ) и метаболизму, который в данном случае рассматривается как некий «черный ящик», генерирующий собственный случайный шум.
От одних подсистем шум может передаваться другим по нескольким каналам, причем влияние может быть как положительным (когда рост одного показателя способствует росту другого), так и отрицательным. В изученной системе отрицательная связь — это обратное влияние μ на E за счет эффекта разбавления (тупичок на схеме). Авторы подчеркивают, что отрицательные связи важны для поддержания гомеостаза, поскольку благодаря им случайные колебания разных подсистем отчасти сглаживают друг друга. В данном случае повышенная концентрация ферментов ведет к ускорению роста, что, в свою очередь, приводит к разбавлению ферментов, что отрицательно сказывается на скорости роста.
Но главным результатом работы, конечно же, является прямая демонстрация того, что ключевые параметры клетки, такие как скорость роста, экспрессия жизненно важных генов и обмен веществ, подвержены сильным хаотическим колебаниям. Случайный шум характерен не только для отдельных генно-регуляторных сетей: по-видимому, он пронизывает все важнейшие клеточные процессы и подсистемы. Осознание этого факта должно привести к переосмыслению роли случайности в формировании фенотипа и в эволюции живых организмов.
Источник: Daniel J. Kiviet, Philippe Nghe, Noreen Walker, Sarah Boulineau, Vanda Sunderlikova & Sander J. Tans. Stochasticity of metabolism and growth at the single-cell level // Nature. 2014. V. 514. P. 376–379.