Проблема адресной доставки лекарств продолжает оставаться весьма насущной, что влечет за собой определенный интерес со стороны исследователей. При этом ученым необходимо решить две взаимосвязанные задачи - адресно доставить препарат на носителе и отделить препарат от носителя, причем последняя задача совсем не проще первой.
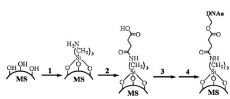
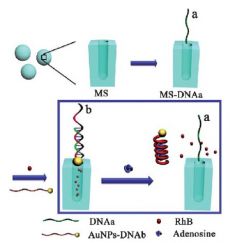
К настоящему времени большая часть носителей чувствительны к изменению температуры, рН или электромагнитному излучению. Однако куда более чувствительными являются так называемые биологические переключатели, например c применением молекул ДНК. В частности, коллектив китайский ученых предложил использовать для транспортировки мезопористые шарики SiO2 (MS), к которым после химического модифицирования поверхности (рис. 1) присоединялась молекула ДНК (aDNA). Затем, поры MS заполнялись гостевыми молекулами (в данном случае для наглядности люминесцирующим родамином B), в то время как поры закрывались наночастицами золота, к которым также пришита молекула ДНК (bDNA), комплементарная aDNA, что приводило к образованию двойной спирали. Так как bDNA была кодирована для распознавания определенного нуклеозида (в данном случае аденозина), то при встрече с ним происходила полная денатурация двойной спирали с высвобождением родамина B из пор.
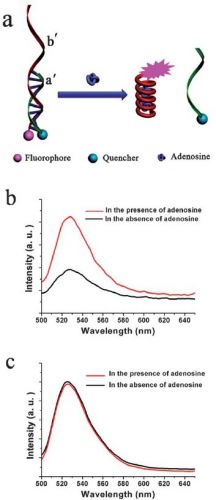
Для доказательства предложенного механизма (рис.2) авторы статьи модифицировали обе цепочки ДНК, "пришив" к одной из них люминофор (родамин зеленый), а к другой тушитель (dabcyl - 4-(4′- диметиламинофенилазо)бензойная кислота). После ренатурации из-за малого расстояния между тушителем и люминофором последний безызлучательно дезактивировался, в то время как после денатурации люминесценции родамина зеленого уже ничего не препятствовало (рис.3).


 Ой! Как интересно! Вот бы поучаствовать в этом, хотя бы что-нибудь сделать "на коленке". А в школе что-нибудь можно?
Ой! Как интересно! Вот бы поучаствовать в этом, хотя бы что-нибудь сделать "на коленке". А в школе что-нибудь можно?