ДНК, как и другие биологические макромолекулы (РНК, белки), обладает удивительно строгой организацией на наноразмерном уровне. Эту особенность можно использовать как мощный инструмент для конструирования наноструктур и наноизделий «снизу вверх». С точки зрения нанотехнологии важным качеством молекулы ДНК является ее способность распознавать и связывать комплементарные основания, а также относительная стабильность двойной спирали ДНК, и гораздо меньшее внимание уделяется генетической или иной биологической роли ДНК. ДНК как носитель и регулятор генетической информации – область интересов, скорее, биотехнологии. Истоком ДНК-нанотехнологии служат работы Недриана Симана (Nadrian Seeman, рисунок 1), начатые около 30 лет назад [1]. Тогда казалось, что при помощи правильно подобранных цепей ДНК можно сложить фигуру любой сложности, соответствующую любым целям. В целом действительность не обманула ожиданий учёных. Можно выделить две существенные области использования ДНК в нанотехнологии: ДНК как структурный элемент для создания сложных конструкций и ДНК как функциональный элемент в наномашинах.
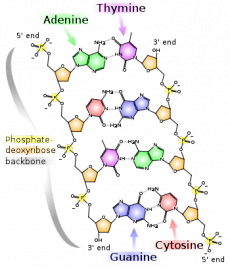
Мир ДНК кажется логичным, строгим и чуть ли не математически правильным. Две антипараллельные цепи ДНК, обвиваясь одна вокруг другой, формируют двойную спираль (дуплекс). Напротив каждого азотистого основания одной цепи находится строго определённое азотистое основание другой цепи: аденин (А) напротив тимина (Т), гуанин (G) напротив цитозина (C) (рисунок 2). Такое взаимодействие называется каноническим, или Уотсон-Криковским по имени учёных, предположивших и впоследствии доказавших формирование комплементарных пар (Фрэнсис Крик и Джеймс Уотсон вместе с Морисом Уилкинсом получили в 1962 году Нобелевскую премию по физиологии и медицине за выдающийся вклад в расшифровку структуры ДНК). Соседние пары оснований связаны ещё и стекинг взаимодействием, что обеспечивает дополнительную жёсткость и стабильность молекулы ДНК. В физиологических условиях двойная цепь ДНК существует преимущественно в В-форме со следующими параметрами: один виток спирали состоит из 10.4 пар нуклеотидов, имеет 3.4 нм в длину и около 2.2 нм в диаметре; ширина большой бороздки 2.2 нм, ширина малой бороздки 1.2 нм (рисунок 3). Нуклеотидный состав ДНК практически не влияет на параметры двойной спирали, что существенно развязывает исследователям руки. Ведь получается, что нуклеотидная последовательность ДНК может быть любой, отвечающей целям исследователя, и не будет вносить искажений в рассчитанную структуру.
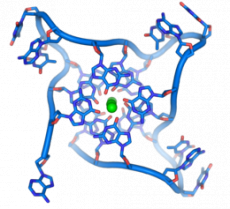
В некоторых случаях, однако, сам состав цепи ДНК оказывается всё же достаточно важным: так, участки, богатые гуанином, склонны формировать гуаниновые квадруплексы, стабилизированные ионом металла, вместо двойной спирали (рисунок 4). В условиях, отличных от физиологических: при изменении pH, ионной силы, – В-форма ДНК может переходить в А-форму либо, при определенном нуклеотидном составе, Z-форму, при этом длина двойной спирали уменьшается либо увеличивается, изменяется число нуклеотидов на виток. Живая клетка – тоже в некотором роде нанотехнолог; она использует разные состояния молекулы ДНК, чтобы регулировать активность генов, сделать те или иные участки более доступными или недоступными для ферментов, для репликации и транскрипции. Нанотехнолог-учёный использует механизмы, отточенные клеткой, и, пользуясь всей широтой накопленных знаний, конструирует наноструктуры или наномашины для собственных целей.
Тут следует внести небольшое уточнение к самому процессу изготовления и сборки этих структур. После того, как возникла идея, необходимо подобрать нуклеотидный состав цепей ДНК с таким расчётом, чтобы в задуманной структуре реализовалось максимально возможное число Уотсон-Криковских взаимодействий. Короткие олигонуклеотиды обычно синтезируют химически; современные технологии позволяют легко и дёшево синтезировать олигонуклеотиды длиной вплоть до 160 оснований. Более длинные фрагменты ДНК, от сотен до нескольких тысяч оснований, можно синтезировать ферментативно методом ПЦР. А дальше наступает момент чуда – точнее, момент самосборки: смешав все необходимые фрагменты ДНК в нужных пропорциях в подходящих условиях, исследователь ждёт, пока комплементарные пары отыщут друг друга и сформируют в точности ту структуру, которую он рисовал себе в воображении или в графическом редакторе… Таким образом, вся сложность использования ДНК в качестве структурного элемента состоит в рождении идеи. Подбор олигонуклеотидных последовательностей осуществляется программно, синтез не представляет проблемы, и если эти этапы пройдены без ошибок, самосборка пройдет без осложнений.
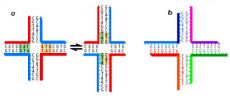
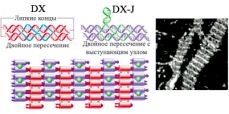
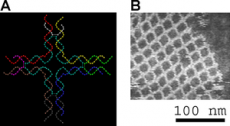
Проблема может возникнуть в неожиданном месте. Так, вдохновлённый открытыми перед ним возможностями, Нед Симан еще осенью 1980 года предложил собрать из двойных цепей ДНК объёмные фигуры: куб, усечённый октаэдр. Однако вскоре выяснилось, что хотя рёбра полученных конструкций обладают достаточной жёсткостью, углы не выдерживают никакой критики, и получающиеся фигуры далеки от совершенства. Поэтому учёные перешли из трёхмерной области для начала в двумерную и разработали прочные структурные мотивы, которые могли бы служить строительными кирпичиками для сборки протяжённых двумерных полей. Это, прежде всего, DX-мотив – две двойные спирали с двумя пересечениями (четырёхсвязными узлами). Стоит отметить, что похожая структура встречается в живой природе и известна как структура Холлидея. Это очень редкий пример существования разветвлённых структур ДНК в естественной среде. Структуры Холлидея формируются на определенном жизненном этапе между гомологичными дуплексами ДНК. В этом случае каждая из четырёх цепей ДНК, образующих эту структуру, комплементарна сразу двум цепям: цепи из своего и из соседнего дуплекса. Благодаря этому точка пересечения не строго определена и может смещаться в ту или иную сторону. Нанотехнологи не полагаются на волю случая и подбирают олигонуклеотиды так, чтобы точка пересечения была чётко задана (рисунок 5). В DX-блоках центральные части цепей комплементарны не своей паре, а цепи из соседнего дуплекса, благодаря чему образуется два пересечения (узла). Другими элементарными структурными кирпичиками являются DX-блоки с добавочной петлёй (DX-J), трёхсвязные узлы, выступающие «липкие концы». Сочетания этих элементов позволяют конструировать множество нанообъектов. Например, DX-блоки с чередующимися липкими концами подходят для синтеза протяжённых плоских массивов (рисунок 6, [2]) и полых трубок [3]. Повторяющиеся мотивы-перекрёстки позволяют создать двумерную сеть (рисунок 7) [4].
Яркой иллюстрацией программированной сборки ДНК в определённые паттерны служит метод ДНК-оригами, предложенный Полом Ротмундом (Paul Rothemund), когда одна длинная одноцепочечная (например, вирусная) ДНК укладывается определённым образом при помощи относительно коротких олигонуклеотидных ДНК-скрепок, которые соединяют участки длинной ДНК и создают строго заданный рисунок (рисунок 8) [5]. О ДНК-оригами Нанометр писал много и с большим удовольствием. До сих пор поражают воображение трёхмерные наношкатулки, снабжённые к тому же нанозамочком, который можно запирать и отпирать (рисунок 9) [6].
Массивы ДНК могут быть связаны с органическими и неорганическими молекулами или частицами. Здесь могут преследоваться разные цели: ДНК можно модифицировать для удобства дальнейших манипуляций (например, тиольными группами), для придания молекуле дополнительной функциональности (красителями, белками), для геометрически заданного расположения интересующих элементов.
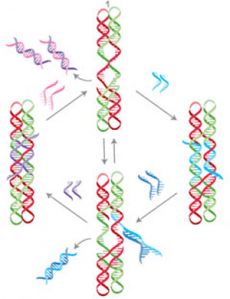
Использование ДНК как функционального элемента в наномашинах основывается, опять же, на комплементарном взаимодействии, а также на способности одноцепочечной ДНК вытеснять одну из цепей дуплекса при условии, что вытесняющая цепь образует больше комплементарных взаимодействий, чем вытесняемая. Эта замечательная способность была продемонстрирована в 2000 году Бернардом Юрке (Bernard Yurke) и его коллегами [7]. Достаточно оставить на одной из цепей дуплекса несколько нуклеотидов (выступающий «липкий конец»), и тогда при добавлении одноцепочечной ДНК, которая полностью комплементарна более длинной цепи, эта ДНК сначала свяжется со свободным одноцепочечным фрагментом, а затем вытеснит более короткую цепь из дуплекса. На основе этого свойства разработаны молекулярные переключатели (рисунок 10, [8]) и даже логические схемы [9].
Похожий принцип применяется и тогда, когда цепи изначально не полностью комплементарны, но в определённых условиях места несовпадений могут быть стабилизированы. Например, два расположенных друг напротив друга остатка тимина не образуют комплементарную пару, но при добавлении солей ртути формируется комплекс Т-Hg2+-Т. При отсутствии ионов ртути связывание происходит предпочтительно с другой цепью ДНК, в которой напротив остатка тимина расположен аденин (образуется каноническая пара А-Т). Таким образом, получается молекулярная машина, чувствительная к присутствию ионов Hg2+ [10].
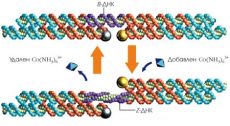
Нашла своё применение и способность ДНК принимать необычную конформацию в зависимости от условий. Так, в 1999 году Мао, Симан и коллеги опубликовали в Nature статью, где показали, что если связать DX-блоки особой двуцепочечной ДНК, состоящей из чередующихся остатков гуанина и цитозина, то при добавлении соли Co(NH3)6+ эта связывающая ДНК переходит в Z-форму, благодаря чему DX-блоки поворачиваются относительно друг друга. При удалении соли связующая ДНК снова переходит в В-форму (рисунок 11) [11].
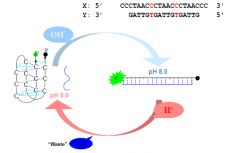
Другая необычная конформация ДНК, также нашедшая место в нанотенологии – это так называемая i-форма, образованная четырьмя богатыми цитозином цепями ДНК. Эта форма стабильна при низких значениях рН и разрушается при рН>6.3. На основе этого свойства созданы молекулярные машины, чувствительные к кислотности среды: одна из цепей ДНК, способная сворачиваться в i-форму, модифицирована на концах флуоресцентным красителем и гасителем флуоресценции (рисунок 12). В щелочной среде формируется двойная спираль (В-форма), флуорофор и гаситель пространственно разделены и не взаимодействуют; наблюдается флуоресценция. При понижении рН предпочтительной становится i-форма, гаситель сближается с флуорофором и излучение не наблюдается [12].
О конкретных интересных и изящных решениях задач в рамках ДНК-нанотехнологии вы также можете прочитать (и написать) на сайте Нанометр.
Литература:
1. Seeman N. (1982). "Nucleic acid junctions and lattices". Journal of Theoretical Biology 99 (2): 237.
2. Winfree E.; Liu F.; Wenzler L. A., Seeman N. C. (1998). "Design and self-assembly of two-dimensional DNA crystals". Nature 394 (6693): 529–544.
3. Sharma J., Chhabra R., Cheng A., Brownell J., Liu Y., Yan H. (2009). “Control of Self-Assembly of DNA Tubules Through Integration of Gold Nanoparticles”. Science 323 (5910): 112-116.
4. Yan H., Park S. H., Finkelstein G., Reif J. H., LaBean T. H. (2003) “DNA-templated self-assembly of protein arrays and highly conductive nanowires”. Science 301: 1882–1884
5. Rothemund, P. W. K. (2006). "Folding DNA to create nanoscale shapes and patterns". Nature 440 (7082): 297–302.
6. Andersen E.S., Dong M., Nielsen M. M., Jahn K., Subramani R., Mamdouh W., Golas M. M., Sander B., Stark H., Oliveira C. L. P., Pedersen J. S., Birkedal V., Besenbacher F., Gothelf K. V., Kjems J. (2009). “Self-assembly of a nanoscale DNA box with a controllable lid”. Nature 459: 73-7
7. Yurke B., Turberfield A. J., Mills A. P. Jr., Simmel F. C., Neumann J. L. (2000). “A DNA-fuelled molecular machine made of DNA”. Nature 406 (6796): 605-8.
8. Yan H., Zhang X., Shen Z., Seeman N. C. (2002). “A robust DNA mechanical device controlled by hybridization topology”. Nature 415(6867): 62-5.
9. Voelcker N. H., Guckian K. M., Saghatelian A., Ghadiri M. R. (2008). “Sequence-Addressable DNA Logic”. Small 4 (4): 427-431.
10. Wang Z-G., Elbaz J., Willner I. (2011). “DNA Machines: Bipedal Walker and Stepper”. Nano Lett. 11 (1): 304–309.
11. Mao C., Sun W., Shen Z., Seeman N. C. (1999). "A DNA Nanomechanical Device Based on the B-Z Transition". Nature 397 (6715): 144–146.
12. Liu D, Balasubramanian S. (2003). “A proton-fuelled DNA nanomachine”. Angew Chem Int Ed Engl. 42(46): 5734-6.