1. Перспективы и проблемы водородной энергетики.
Существование земной цивилизации напрямую связано с тем, какие виды источников энергии будет использовать человечество. Одной из проблем современности является поиск новых источников энергии, которые в недалеком будущем могли бы заменить нефть, газ и каменный уголь, запасы которых, по оценкам специалистов, истощатся в ближайшие сто лет. Наиболее перспективным направлением среди известных технологий получения и транспортирования энергии является водородная энергетика (ВЭ). ВЭ и водород характеризуются следующими особенностями [1]:
- в природе водорода очень много – это вода, на Земле содержание Н2 составляет 17 ат. %;
- Н2 является самым легким элементом, поэтому имеет самую высокую энергоемкость в расчете на единицу массы – 121 МДж/кг;
- продуктом окисления (сгорания) Н2 является Н2О – экологически самый безопасный продукт;
- в случае утечки Н2 при громадных объемах его использования он не накапливается в атмосфере Земли: легкие молекулы Н2 в результате столкновения с молекулами воздуха «разгоняются» до первой космической скорости и улетают за пределы земного тяготения;
- разработаны топливные элементы, в которых вырабатывают электрическую энергию с использованием Н2 и О2 воздуха с к. п. д. ≈ 80 %.
В то же время, перспективы масштабного использования ВЭ не так уж безоблачны, как и во всякой технологии, имеется ряд проблем:
- трудности в накоплении и хранении Н2 – этот газ образует с воздухом взрывоопасные смеси, горюч;
- сжижается при очень низкой температуре –253 ºС, поэтому его хранение в жидком состоянии очень затратно: его надо охлаждать жидким гелием;
- хранение Н2 под большим давлением затруднено, что связано с высокой проникающей способностью его молекул.
2. Уникальные свойства нанопорошков алюминия.
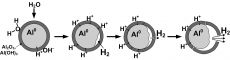
Известно, что активные металлы (Mg, Be и Al) являются носителями запасенной химической энергии, которая может быть извлечена при их сжигании. В то же время, при взаимодействии с Н2О и водными растворами многие металлы окисляются протонами и дают Н2. Молярная масса Mg составляет 24 г/моль, при его окислении на получение 22,4 л Н2 расходуется 24 г Mg. При окислении в Н2О 27 г Al образуется 33,6 л Н2, т. е. в 1,5 раза больше. Выпускаемые промышленностью порошки Al взаимодействуют с Н2О медленно, причем реагирует всего на 20…30 мас. %, после чего процесс замедляется. Качественный скачок произошел в середине 80-х гг. прошлого столетия, когда в СССР была принята программа по развитию электровзрывной технологии получения ультрадисперсных (нано-) порошков (НП). Уже первые опыты, выполненные в нашем коллективе, показали, что полученный с помощью электрического взрыва проводников в среде аргона и непассивированный НП Al (рис. 1) реагирует с водой за несколько секунд и полностью [2]. С появлением НП с высокой реакционной способностью значительно расширились возможности и технологичность получения Н2. В процессе исследования реакции НП Al с Н2О были установлены новые, ранее неизвестные закономерности.
3. Запасенная энергия в нанопорошках алюминия.
Еще с 80-х гг. прошлого столетия высокие скорости взаимодействия полученного в условиях электрического взрыва НП Al с О2 и Н2О побуждали мысль о запасенной энергии в НП. Методами сжигания в кислороде под давлением 2 МПа и растворения в изотермических условиях удалось измерить тепловые эффекты. Их превышение (т. е. запасенная энергия) составила до 80 кДж на моль исходного НП. При пересчете на содержание металлического Al в НП (92…94 мас. %) эта величина составляет приблизительно 100 кДж на моль НП. Чтобы оценить неординарность этого эффекта, достаточно вспомнить, что теплота плавления Al в массивном состоянии равна 13,6 кДж/моль. С точки зрения термодинамики этот результат не имеет объяснения: если в 1 моль Al закачать такую энергию – 100 кДж, то он должен расплавиться. Исследования показали, что, действительно, такое состояние для НП изученного размерного диапазона диаметра частиц от 60 до 150 нм возможно. Энергия запасается в виде двойного электрического слоя с высокой псевдоемкостью, сформировавшегося в условиях электрического взрыва и усиливавшегося при пассивировании. Необходимо подчеркнуть, что запасенная энергия не связана с энергией поверхности: для частиц такого диаметра она не превышает 4 кДж/моль. При сжигании и при протекании химических реакций запасенная энергия выступает в роли «стартового допинга» (спускового механизма), понижая температурные пороги процессов.
4. Эффект саморазогрева наночастиц в воде.
Особенности теплового режима процесса взаимодействия НП Al с Н2О приводят к появлению новых эффектов, которые не были известны для реакции с участием крупных порошков Al. В первую очередь – это эффект саморазогрева наночастиц до температур, превышающих температуру окружающей воды на сотни градусов. Рассмотрим причины проявления данного эффекта. При использовании промышленного порошка Al АСД-1 скорость выделения Н2 составляет лишь 1,38×10–4 л/с×г (0,138 мл в секунду на 1 г порошка). При этом в конечный продукт – смесь оксидов и гидроксидов Al – превращается только 20…30 % исходного Al [3]. Исследования, проведенные нашим коллективом, показали, что НП Al по своей реакционной способности превосходят обычные промышленные порошки типа АСД-1. В то же время, скорость выделения Н2 при взаимодействии НП Al с дистиллированной водой при 60 °С составляет 3 мл/с×г, при 80 °С – 9,5 мл/с×г, что превышает скорость выделения Н2 при гидротермальном синтезе приблизительно в 70 раз. Другим преимуществом использования НП в данной реакции является то, что степень превращения Al составляет 98…100 % (в зависимости от температуры). Более того, введение в дистиллированную воду даже незначительных количеств щелочи приводит к значительному возрастанию скорости реакции: при увеличении рН раствора до 12 скорость выделения Н2 возрастает до 18 мл/с×г при 25 °С. Скорость выделения Н2 при растворении АСД-1 в растворе, содержащем 8 г/л NaOH, при этой же температуре, составляет лишь 1 мл/с×г. Приведенные данные показывают, что НП Al, в отличие от компактного Al и крупных промышленных порошков, взаимодействуют с Н2О с большой скоростью и степенью превращения ~100 % и именно их применение позволит получать Н2 с достаточной скоростью при обычных условиях.
Реакция Al с Н2О является экзотермической, т. е. в ходе взаимодействия выделяется теплота. Расчеты показывают, что при полном взаимодействии 27 г Al (1 моль) с Н2О с образованием аморфного Al(OH)3 и Н2 по реакции (3) выделяется 418 кДж теплоты. Такое же количество теплоты выделяется при сгорании ~ 13 г углерода. Очевидно, что в зависимости от соотношения масс взятых Al и Н2О, а также скорости реакции (иными словами – скорости производства теплоты) и скорости отвода тепла в окружающую среду, реакционная смесь может иметь относительно постоянную температуру, а может и постепенно нагреваться, что, в свою очередь приводит к возрастанию скорости реакции. Оценим температуру, до которой может нагреться смесь НП Al с Н2О в ходе реакции. Минимальная масса Н2О, необходимая для полного расходования 27 г Al с образованием продуктов, согласно стехиометрии реакции (3), составляет 54 г. Выделяющегося при этом количества теплоты, при условии отсутствия ее отвода в окружающую среду, достаточно для нагрева продуктов реакции до температуры ~ 2300 °С. Естественно, на практике реакцию в таком режиме (адиабатическом) не проводят. Небольшой избыток воды, превышающий стехиометрически необходимое ее количество, например, в 2 раза, приводит к резкому понижению температуры за счет нагревания этого избыточного количества воды.
Нашим коллективом впервые был обнаружен и экспериментально обоснован «эффект саморазогрева»: это превышение температуры внутри наночастиц в сравнении с температурой окружающей среды, в которой или с которой протекает химическая реакция [4]. Этот эффект объясняется наличием значительной доли атомов на поверхности наночастицы, сравнимой с долей атомов в объеме частицы. Тепло, выделяющееся в реакции, аккумулируется в металлической составляющей наночастицы. Тем не менее, был найден косвенный способ определения максимальной температуры саморазогрева.
5. Продукты взаимодействия нанопорошков алюминия с водой, сформированные в условиях саморазогрева.
Следствием саморазогрева частиц НП Al является различное химическое и фазовое состояние твердых продуктов взаимодействия его с Н2О. Одновременно состав продуктов отражает значение температуры внутри частицы: это своеобразный тест на температуру. В настоящее время прямых методов определения температуры внутри нанообъектов не разработано. Природа оказалась щедра, подарив нам цепочку фазовых превращений продуктов окисления Al в зависимости от температуры (рис. 2). Эта цепочка превращений может быть положена в основу предприятия, выпускающего продукцию различного ассортимента.
Наличие саморазогрева наночастиц Al и высокая скорость образования Н2 приводят к его накоплению на границе раздела металл-оксид (гидроксид) металла и к разрыву оксидно-гидроксидной оболочки. В результате данных процессов твердые продукты реакции образуют наноструктуры, которые до использования НП получить не удавалось. Наиболее удивительным фактом является то, что размеры структурных элементов – пор, слоев – не превышают 100 нм, а в ряде случаев – и десятков нм (рис. 3). Кроме продуктов с такой морфологией в зависимости от температурного и гидродинамического режимов реакции удается получить еще несколько типов продуктов, различающихся по структуре и химическому составу. Наиболее удивительными по своей морфологии являются продукты, состоящие из пустотелых сфер или их фрагментов размерами, не превышающими 100…200 нм. Образование таких «скорлупок» – довольно интересное проявление так называемого химико-механического эффекта, который также является следствием саморазогрева наночастиц Al в ходе их взаимодействия с Н2О. То есть, в отличие от механохимического эффекта, в котором химические реакции протекают под действием механических нагрузок, в данном случае, наоборот, химическая реакция приводит к механическому разрушению.
Факт образования пустотелых сфер, состоящих из (гидр)оксидов Al различных модификаций, можно объяснить следующим образом [4]. Толщина оксидной оболочки на поверхности наночастиц Al неравномерна, и очевидно, взаимодействие Al с Н2О начинается в тех местах, где эта оболочка более тонкая. Поскольку на таком участке поверхности частицы диффузионные затруднения в ходе взаимодействия минимальны, фронт реакции развивается неравномерно и частица в большей степени «вытравливается» именно со стороны указанного участка. В итоге при израсходовании Al от наночастицы остается лишь ее оболочка – «скорлупа». Было установлено, что продукты с такой морфологией получаются в относительно мягких условиях – при относительно большом избытке Н2О и температуре реакционной смеси, не превышающей 70 °С. Повышение температуры смеси способствует, по-видимому, разрушению таких пустотелых образований и формированию продуктов с ячеистой структурой. Образующиеся осколки оксидно-гидроксидной оболочки имеют вид скорлупок (рис. 4).
С точки зрения генерирования Н2, химикомеханический эффект способствует резкому увеличению скорости реакции: разрыв оксидно-гидроксидной оболочки приводит к проникновению Н2О непосредственно к поверхности металла. Н2 образуется на границе раздела металл-оксид (гидроксид) металла и имеет высокую температуру – температуру саморазогрева, а она составляет сотни градусов. При 400 ºС Н2 эффективно диффундирует через пластину никеля толщиной 10 см.
6. Понижение температуры кипения воды как результат саморазогрева наночастиц алюминия.
Может ли вода кипеть при атмосферном давлении при температуре ниже 100 ºС? Оказалось, что добавление НП Al в Н2О приводит к понижению температуры кипения воды [4]. Величина этого понижения зависит от активности НП. Если бы понижение температуры кипения было связано с законом Рауля, то оно зависело бы от содержания НП Al в воде, а не от активности НП. Образующиеся в результате реакция Al с Н2О пузырьки Н2 насыщаются парами Н2О, всплывают к поверхности, где лопаются, выбрасывая в атмосферу пары Н2О. Измерение температуры кипящей воды проводили с помощью термопар и образцовых ртутных термометров. Объяснение этому эффекту было дано с привлечением модели «горячего» Н2. Пузырек Н2, сформированный на поверхности наночастицы Al, внутри содержит молекулы Н2 с большой кинетической энергией, которая передается молекулам Н2О при соударении с молекулами Н2, вызывая тем самым парообразование на внутренней поверхности газового пузырька. Продвигаясь к поверхности воды, пузырек постепенно насыщается парами Н2О. А при достижении поверхности пузырек разрушается, выбрасывая пары Н2О в атмосферу.
7. От водородной энергетики – к водородной цивилизации.
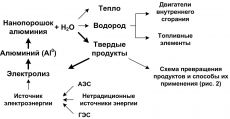
Одним из способов решения проблем транспортировки и хранения Н2 может стать использование генераторов Н2 на основе НП Al. При взаимодействии с Н2О одного килограмма НП Al выделяется 1244,5 л Н2, который при сжигании дает 13,43 МДж тепла. Эффективность такого процесса получения Н2 выше, чем в случае электролиза – окисление НП Al протекает на 100 %, т. е. применяемый материал используется полностью.
На схеме (рис. 5) приведен энергетический цикл на основе НП Al, показано, что при взаимодействии последнего с Н2О выделяется Н2, тепло и образуются твердые продукты, которые могут быть использованы как функциональные материалы (рис. 2) или могут быть направлены на переработку в металлический Al с последующей переработкой в НП, замыкая энергетический цикл. Данная схема может стать основой для безотходной технологии газообразного Н2. Для ее функционирования необходим внешний источник энергии, которым может служить АЭС, ГЭС, а также любой из нетрадиционных источников энергии.
Заключение.
Комплексное использование продуктов взаимодействия НП Al с Н2О, утилизация тепла и эффективное функционирование энергетического цикла на основе НП Al – это реальная технология газообразного Н2 для ВЭ совсем недалекого будущего. Применение НП Al дает неоспоримые преимущества: исчезает необходимость в хранении и транспортировании газообразного Н2, что существенно повышает пожаро- и взрывобезопасность этого фрагмента ВЭ. При промышленном производстве НП Al, в том числе и для других направлений его применения себестоимость его снизится в несколько раз. Уже в настоящее время целесообразно применение НП Al в мобильных малогабаритных источниках Н2, например, для гибридных автомобильных двигателей, для использования в труднодоступных районах. НП Al может быть основой ВЭ для поселений на Луне, а также – источником Н2 в топливных элементах для экспедиций, направляемых на Марс. Поэтому на повестке дня стоит проблема технического характера – разработка мобильных источников Н2, совмещенных с топливными элементами, которые необходимы для выработки электрической энергии.
Список литературы.
- Дигонский С.В., Тен В.В. Неизвестный водород. – СПб.: Наука, 2006. – 292 с.
- Проскуровская Л.Т. Физико-химические свойства электровзрывных ультрадисперсных порошков алюминия: Дис. …к.х.н. – Томск, 1988. – 155 с.
- Ильин А.П., Громов А.А. Горение алюминия и бора в сверхтонком состоянии. – Томск: Изд-во Том. ун-та, 2002. – 154 с.
- Ляшко А.П. Особенности взаимодействия с водой и структура субмикронных порошков алюминия. Дисс. … к.т.н. – Томск, 1988. – 178 с.







 .
.